在全球化浪潮汹涌澎湃的今天,医疗行业的国际交流合作愈发频繁紧密。从前沿医学研究成果的跨国分享,到跨境医疗旅游服务的蓬勃兴起,语言障碍成为横亘在高效沟通与深度协作面前的一道高墙。而专注于医疗领域的专业翻译公司,上海因特普林,凭借卓越精准的翻译服务,专业团队,医学知识与语言能力深度融合,为全球医疗交流合作开辟通途,成为医疗行业跨越语言界限的得力伙伴。新药上市环节繁琐,涉及大量资料的翻译。
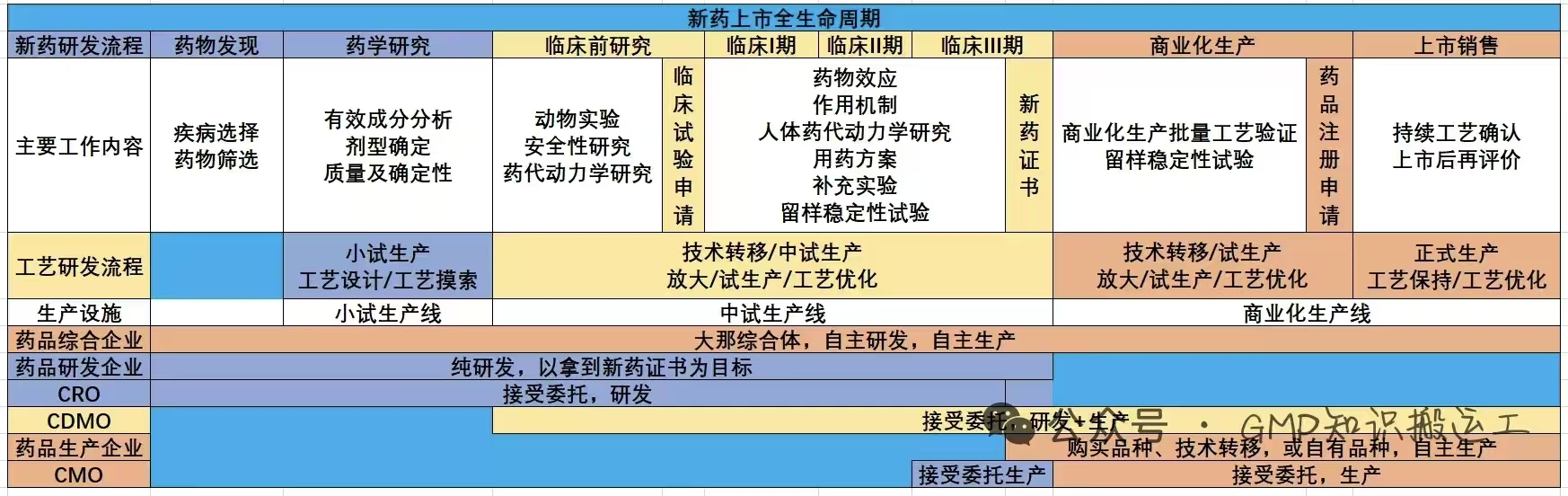
一、新药研发的核心流程
分为I-IV 期,逐步验证药物的安全性、有效性和适用人群,耗时通常占整个研发周期的 50% 以上。
因特普林翻译深知医疗翻译绝非简单的语言转换,而是需要对医学专业知识有着深刻理解与精准把握。公司精心组建了一支由医学博士、专业译员及行业资深专家构成的翻译团队。这些医学背景深厚的专业人士,不仅在各自的医学领域造诣精深,还具备出色的源语言与目标语言驾驭能力。无论是晦涩难懂的医学研究报告、严谨规范的药品说明书,还是复杂精密的医疗器械操作手册,他们都能以专业的素养与精湛的翻译技巧,确保译文的准确性与专业性,让每一份医疗文件在不同语言间流转时都能完整精准地传达信息,为医疗决策提供可靠依据,为患者安全保驾护航。
药品注册资料包括行政文件、CMC资料、临床前研究资料、临床研究资料,在美国上市的所有新药都必须遵守美国相关新药申请法规,事先接受美国食品药品管理局的审理并取得其批准。FDA下属的化学类药物评价与研究中心是其属下的 五个中心之一。此中心的职责为审评并批准申请在美上市的化学类药品及某些生物类药品的安全性、有效性及质量可控性。新药申请材料中相当一部分涉及药品的药物化学、药品生产以及生产和质量监控。以下是上海因特普林公司为客户翻译的10种文件:
药品注册文件翻译
患者报告的结果测量、招募材料和日记翻译
病例报告表翻译
发展安全最新报告翻译
包装和产品标签翻译
毒理学报告翻译
传单和说明手册翻译
药品监管文件和其他药物警戒报告翻译
临床试验和结果评估文件翻译
临床研究和医学文献资料翻译
为什么上海因特普林做医药翻译这么专业?
上海因特普林翻译公司负责医药翻译的译审的简历如下:现为美国FDA化学药物评价与研究中心新药质量审评部审评员,主要负责新药审评以及临床试验申请材料中有关化学、生产以及控制的部分。 1983年毕业于兰州大学化学系分析化学专业,1985年获该校硕士学位。1989年赴美国密苏里大学攻读博士学位。1993年进入FDA药品分析中心继续从事手性化合物的分析分离及测定方法的研究,并参与制定手性化合物分析有关指南的制定。后供职于默克公司。2006年加入FDA新药质量审评部。
医疗无国界,上海因特普林翻译服务亦无语言界限。公司提供涵盖全球主要语种的医疗翻译服务,无论是英语、西班牙语、法语、德语等国际通用语言,还是日语、韩语、阿拉伯语等具有区域特色的语言,乃至小众语种,都能满足客户需求。无论是国际医学会议上专家们的精彩演讲、跨国药企的临床试验文档,还是远程医疗会诊中的医患交流,我们都能确保信息在不同语言间顺畅传递,促进全球医疗资源的共享与整合,推动医疗行业的国际化进程。
严格质量把控,铸就卓越翻译品质
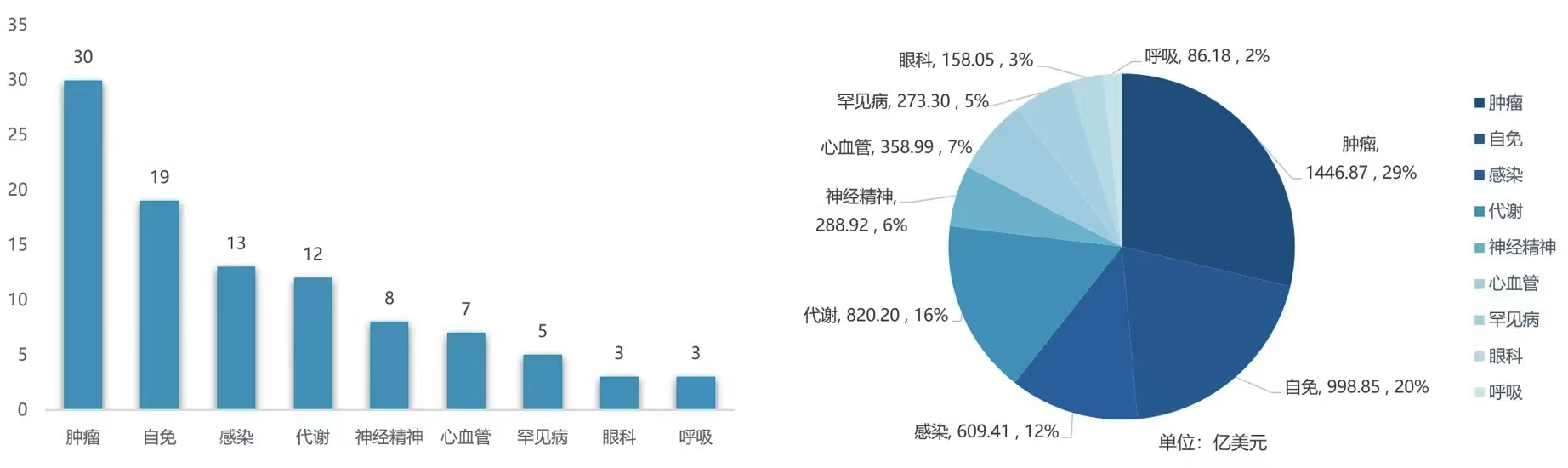
质量是翻译服务的生命线,在医疗领域更是关乎生死安危。上海因特普林翻译建立了一套严谨缜密、贯穿全程的质量控制体系。从译员的选拔与培训,到翻译流程的标准化管理,再到译文的多重审核校对,每一个环节都严格把关,不放过任何一个可能影响翻译质量的细节。我们采用先进的翻译辅助工具与技术,结合人工翻译的智慧与情感,确保译文不仅在语言层面精准无误,更在专业内容与文化内涵上高度契合,为客户呈献高品质、零差错的医疗翻译成果,赢得了全球众多医疗机构、药企及医疗从业者的信赖与赞誉。数据安全保障,严守医疗机密,医疗行业涉及大量敏感信息与机密数据,如患者隐私、临床试验数据、未公开的医学研究成果等。上海因特普林翻译高度重视数据安全与隐私保护,投入大量资源构建了坚如磐石的数据安全防护体系。采用先进的加密技术对医疗文件进行传输与存储,严格限制访问权限,确保只有经过授权的人员才能接触到相关数据。同时,与每一位员工及合作伙伴签订严格的保密协议,从法律层面保障客户数据的安全与机密性,让客户在享受翻译服务时无后顾之忧,放心托付。新药涉及适应症如下:
定制化服务,满足多元医疗场景需求
不同的医疗场景有着截然不同的翻译需求,上海因特普林翻译始终坚持以客户为中心,提供个性化、定制化的翻译解决方案。无论是大型国际医学研讨会的同传服务、医院的多语种标识与病历翻译,还是药企的全球注册申报文件翻译,我们都能根据客户的特定需求、项目规模与时间要求,量身定制最合适的翻译服务套餐。专业的项目管理团队全程跟进协调,确保项目按时交付、质量上乘,为每一位客户创造独一无二的优质翻译体验,助力医疗行业的多元业务拓展与创新发展。
在医疗行业国际化发展的伟大征程中,上海因特普林翻译以专业、精准、可靠的翻译服务,为全球医疗交流合作搭建起坚固而畅通的桥梁。让我们携手共进,打破语言壁垒,共绘全球医疗事业的美好未来!我们的客户:

医药翻译涉及语种
英语医药翻译 | 日语医药翻译 | 韩语医药翻译 | 德语医药翻译 | 法语医药翻译 | 俄语医药翻译 |
意大利语医药翻译 | 阿拉伯语医药翻译 | 荷兰语医药翻译 | 土耳其语医药翻译 | 泰语医药翻译 | 马来语医药翻译 |
希腊语医药翻译 | 印地语医药翻译 | 乌尔都语医药翻译 | 瑞典语医药翻译 | 中文医药翻译 | 丹麦语医药翻译 |
孟加拉语医药翻译 | 希伯莱语医药翻译 | 藏语医药翻译 | 缅甸语医药翻译 | 蒙古语医药翻译 | 匈牙利语医药翻译 |
马其顿语医药翻译 | 塞尔维亚语医药翻译 | 保加利亚语医药翻译 | 尼泊尔语医药翻译 | 老挝语医药翻译 | 芬兰语医药翻译 |
克罗地亚语医药翻译 | 汉语医药翻译 | 爱沙尼亚语医药翻译 | 乌克兰语医药翻译 | 哈萨克语医药翻译 | 威尔士语医药翻译 |
吉普赛语医药翻译 | 亚美尼亚语医药翻译 | 罗马尼亚语医药翻译 | 柬埔寨语医药翻译 | 吉尔吉斯语医药翻译 | 克什米尔语医药翻译 |
格鲁吉亚语医药翻译 | 拉脱维亚语医药翻译 | 泰米尔语医药翻译 | 豪萨语医药翻译 | 斯洛伐克语医药翻译 | 佛兰芒语医药翻译 |
斯洛文尼亚语医药翻译 | 僧伽罗语医药翻译 | 普什图语医药翻译 | 斯瓦西里语医药翻译 | 库尔德语医药翻译 | 爪哇语医药翻译 |